A mediados del año pasado recibí un correo electrónico con una invitación a participar en un congreso de biofísica. Éste se desarrollaría del 14 al 18 de abril de 2019, justo durante las vacaciones de semana santa que acaba de terminar. No soy mucho de congresos y generalmente invento una excusa para decir que no; que muchas gracias, que esto, que lo otro, que ya tenía otros planes. Pero a este congreso en particular dije que sí. Por dos razones: me ofrecían pagarme el viaje y además el nombre del congreso era muy seductor: POEM. ¿Cómo alguien que gusta de la poesía podría resistir la invitación a un congreso llamado así?

Nos dimos cita en el Physikzentrum de Bad Honnef, a dos horas en tren de Frankfurt, un centenar de científicos: físicos, como yo, biólogos moleculares, químicos, e ingenieros. En el programa estaban varias eminencias. Por ejemplo, Jean Pierre Changeux del Instituto Pasteur en Paris, quien fue pupilo de los galardonados con el premio Nobel de Medicina, Jaques Monod y François Jacob, y que seguro espera el suyo a sus 83 años. Una de las contribuciones más importantes de Changeux fue comprender las regulaciones alostéricas de las proteínas. Puesto en palabras sencillas, se trata de lo siguiente: digamos que en nuestras neuronas hay un racimo de proteínas cada una en su propio estado de equilibrio termodinámico. Llamemos a este racimo, enzima acetilcolinesterasa. Esta enzima tiene 5 sub-unidades y como dije, están en equilibrio con el ambiente. El ambiente es agua, iones, y cuanta biomolécula pase por ahí. Estamos haciendo algo, por ejemplo escribiendo en el lobby de un hotel en Frankfurt porque el congreso ya terminó y voy de regreso a casa, y no me puedo concentrar como quisiera por unos chinos al lado que levantan la voz. Entonces, a ese racimo que está en la parte receptora de una neurona, llamada conexión pos-sináptica, le mando (es un decir) un moleculita llamada acetilcolina (ACh). Dicho sea de paso, esta molécula es el neurotransmisor más abundante en nuestro cerebro. Sin ella no nos podemos concentrar, no podemos recordar, no podemos vivir. Y todo porque la acetilcolina produce un efecto cooperativo que hace funcionar a cinco proteínas que a la voz de ya, se ponen a trabajar. El cerebro funciona así, con una comunicación entre neuronas que no están físicamente conectadas y quien las conecta es la acetlicolina que se produce con el azúcar que hay en la sangre. En fin, el alosterismo es el logro de Monod y Changeux (cuando Changeux era un estudiante). Por eso es tan famoso, ya que la farmacología moderna basa bastantes de sus medicinas en el efecto alostérico de Changeux.

Los organizadores del congreso también invitaron a otra eminencia. Ésta británica: Denis Noble. El primero en concebir un modelo matemático de las células cardiacas. Se le debe la integración de la biología evolutiva con la fisiología. Casi nada. Además, es famoso mundialmente por ser autor del libro: La Música de la Vida, que se opone a la teoría de Dawkins y su gen egoísta. Noble no pudo estar presente, pero dictó mediante Skype una plenaria desde su casa en Oxford. Es un año más joven que Changeux y con seguridad también espera su premio Nobel. Otro que estuvo, y no estuvo, fue Rudolf Rigler, padre de la FCS (Fluorescence Correlation Spectroscopy, por sus siglas en inglés) del Departamento de Bioquímica y Medicina, del Instituto Karolinska, en Suecia. 82 años de edad. También dio su charla por Skype. Es lo malo de invitar a gente de edad, un resfrío y se predisponen. Otro octogenario, que sí asistió, fue Israel Silman, del Instituto Weizmann en Jerusalem. Experto en la enzima acetilconesterasa (AChE), que se encarga de terminar la transmisión del impulso nervioso en las sinápsis coligenéricas. En sus estudios sobre la enzima AChE, logró determinar por rayos X que la ACh es atraída por un campo eléctrico hacia el interior de la enzima. Hasta dentro se inserta el neurotransmisor, justo hasta una cueva formada por anillos aromáticos.
Estas eminencias de la biología molecular defendieron, con sus trabajos de años, sus premios y prestigio, el paradigma actual de las neurociencias que dice más o menos así: lo que nos permite pensar, correr, comer y todo lo que hacemos los seres vivos, es producto de un sistema complejo de señales eléctricas o potenciales de acción, que se transmiten en nuestra red de neuronas; con neurotransmisores que difunden del final de una neurona al inicio de otra, donde proteínas especializadas los atrapan. Para decirlo en términos de Changeux, un verdadero alosterismo frenético trabajando cooperativamente.

El lunes 14 de abril, abrió el congreso Thomas Heimburg del Instituto Bohr de Copenhague. Su libro sobre membranas es lectura obligada de mis estudiantes. Heimburg dio las gracias a todos por asistir y sin más preámbulo abrió fuego:
– Vengo a defender lo que he dicho en otros lugares del mundo: que además de potenciales de acción producidos por iones, por nuestro cerebro se transmiten solitones, ondas solitarias que no disipan calor ni se atenúan. Que por el cerebro se propaguen solamente corrientes eléctricas sin disipar calor no me parece creíble. Es como si esta laptop que uso para proyectar mi plática, no tuviera un abanico interno para enfriarla. Cualquier instrumento que funcione con corrientes eléctricas, se calienta y debemos enfriarlo. Pero según el actual paradigma, al cerebro no. A los biólogos y fisiólogos les gusta medir corrientes de iones, apagar switches moleculares y prenderlos colestéricamente, pero voltean para otro lado y no responden aquella duda que incluso Hodgkin y Huxley (los padres del paradigma y premios Nobel de Fisiología en 1963) ya tenían desde el descubrimiento de su potencial de acción. Las señales se propagan isentrópicamente y a todos les importa poco.
Changeux estaba dormido y no escuchó el dardo del danés. Heimburg continuó, elaborando sobre su modelo del solitón y sus experimentos, y llegó al final de su charla con una conclusión:
– Como las membranas neuronales poseen compresibilidad y conducen el sonido de forma dispersiva (dependiente de la frecuencia), los solitones pueden viajar sin atenuación ni disipación. Justo ésa es su característica, viajar sin disipar calor. Si dos solitones colisionan de frente, siguen su curso como si nada. En cambio, si dos potenciales de acción lo hacen, se aniquilan.
Años antes, Heimburg demostró también que las membranas celulares de bacterias y otros organismos superiores, poseen una transición de fase termodinámica a una temperatura debajo de la temperatura fisiológica. Así, una bacteria que se incuba a 37 grados sintoniza su maquinaria celular para que se produzcan lípidos que le aseguren una transición de fase a su membrana celular a los 33 grados. Abajo de 37. Y pasa algo espectacular, si ahora encubamos las bacterias a 15 grados, ocurre que éstas sintetizan lípidos que ahora dan una transición de fase a 11 grados. Siempre por abajo, porque ahí tiene que estar para asegurar el estado fluido de la membrana a la temperatura en la que vive. Y sucede que, al atravesar la transición de fase, se fugan iones hacia dentro y hacia afuera. Sin la ayuda de proteínas o enzimas, sólo porque la permeabilidad sufre una transición.
Es decir, las señales se pueden propagar, à la Heimburg, por medios inertes que siguen las leyes de la termodinámica. Y con esto llegué al porqué del congreso POEM; son las siglas de Physics of Excitatory Media. Heimburg fue el creador de este congreso. El primero fue justo en suelo danés, en el Instituto Bohr, el segundo éste que narro y ya están planeados el tercero y el cuarto en la Universidades de Oxford y Chicago.
Thomas Heimburg se hizo famoso a nivel mundial cuando en 2005 publicó un artículo en la prestigiosa revista PNAS, que a grandes rasgos dice: lo que se propaga por las neuronas no son potenciales de acción, sino solitones. Aduce cosas muy interesantes, que contradicen al modelo eléctrico de Hodgkin y Huxley.
Nosotros los físicos, que entramos sin invitación a la biología, y nos llamamos biofísicos, tenemos que aprender el complicado léxico de la ciencia de este siglo. En cambio, a los biólogos y neurofisiólogos les importa poco el nuestro. Son como chinos, saben que dominan al mundo, o pronto lo harán. Nosotros somos los que tenemos que aprender a hablar su lenguaje. No se inmutan cuando uno les saca algo que suene a entropía. Ellos estudian la vida y ahí no hay lugar para esa palabra que sabe a muerte (entrópica). Se burlan porque arrastramos para todos lados unas cuantas leyes que intuimos operan también en las biomoléculas. Ellos encuentran una hoy y otra mañana, la cristalizan como les enseñamos a hacerlo hará medio siglo, le ponen nombre, postulan el sitio donde un neurotransmisor o droga se ancla, y listo, la literatura absorbe el nuevo “target” o nuevo “ligando”. Hay miles. En cambio nosotros, buscamos cómo la naturaleza se las arregló para que con las leyes que hay en el universo, la vida floreciera.
Después de Heimburg, se paró al frente Matthias Schneider, investigador de la Universidad de Dormond, Alemania. Nos enseñó los resultados de sus experimentos en una balanza de Langmuir. Una balanza de éstas es como una charolita llena de agua donde se vierte un poco de cloroformo con lípidos disueltos en él.
 Como los lípidos tienen una cabeza polar y unas colas apolares, les gusta tanto el agua como el cloroformo. Pero dado que el cloroformo es volátil, éste se evapora y se escapa de la balanza. A los lípidos nos les queda otra que quedarse con la cabeza bajo el agua y las colas al aire (huyendo del agua). Imagine el lector que las bailarinas de todos los equipos de nado sincronizado, en una olimpiada, se metieran en una alberca a nadar con las piernas para arriba. Así se ven los lípidos, con la cabeza dentro del agua y las colas para arriba. Pues bien, en un sistema así, Schneider encontró que puede disparar solitones a placer. Si alguna vez estos hallazgos son aceptados por todos, en la biología y medicina quiero decir, a Heimburg y Schneider les darán el Nobel. Están jóvenes y saben que les queda mucho por hacer. Schneider dijo algo que se me quedó grabado: ¿por qué si los biólogos siempre hacen experimentos control, no hacen el control del experimento que hicieron Hodgkin y Huxley? Es decir, que demuestren que quitando todo indicio de proteínas, nos les da un potencial de acción. Fue sensato el comentario.
Como los lípidos tienen una cabeza polar y unas colas apolares, les gusta tanto el agua como el cloroformo. Pero dado que el cloroformo es volátil, éste se evapora y se escapa de la balanza. A los lípidos nos les queda otra que quedarse con la cabeza bajo el agua y las colas al aire (huyendo del agua). Imagine el lector que las bailarinas de todos los equipos de nado sincronizado, en una olimpiada, se metieran en una alberca a nadar con las piernas para arriba. Así se ven los lípidos, con la cabeza dentro del agua y las colas para arriba. Pues bien, en un sistema así, Schneider encontró que puede disparar solitones a placer. Si alguna vez estos hallazgos son aceptados por todos, en la biología y medicina quiero decir, a Heimburg y Schneider les darán el Nobel. Están jóvenes y saben que les queda mucho por hacer. Schneider dijo algo que se me quedó grabado: ¿por qué si los biólogos siempre hacen experimentos control, no hacen el control del experimento que hicieron Hodgkin y Huxley? Es decir, que demuestren que quitando todo indicio de proteínas, nos les da un potencial de acción. Fue sensato el comentario.
Según el programa, el turno para hablar era del profesor sueco Rigler. Tampoco fue –uno acepta, con mucha anticipación el compromiso, y nada se puede hacer a la mera hora si nos enfermamos, sobre todo si se es octogenario–, así que le cambiaron a dar su charla por Skype dos días después.
Y el que entró de emergente, es el que esto narra. Aunque ya estaba sobre aviso desde el día anterior:
– Carlos –se paró frente a mí Schneider cuando llegué al Physikzentrum la noche anterior–: Rigler is sick and will not come, ¿could you give the third talk tomorrow?
Sin pensarlo, le respondí que sí. Total, pensé, así me quitaría el estrés de una vez. Y ya que entramos al asunto, he de anotar aquí por qué yo estaba en ese congreso. Matthias Schneider hizo lo que hizo, disparar solitones en monocapas de lípidos, pero nosotros en Monterrey lo hicimos como se debe, en bicapas de lípidos, que son más parecidas a las que rodean a las neuronas.
La historia es la siguiente: hace poco menos de dos años mi alumna de doctorado, Isabel Pérez, y yo, publicamos un artículo en una revista llamada Soft Matter, de la Royal Society of Chemistry. El nombre del artículo es: Propagation of a thermo-mechanical perturbation on a lipid membrane. Reportamos en ese manuscrito el resultado experimental de que sobre una membrana de lípidos puede viajar una perturbación termo-mecánica. El experimento es, en su concepción, muy sencillo, aunque con grandes dificultades técnicas. Isabel se tardó dos años en lograr bicapas de gran longitud (10 cm), construir un sistema térmico para el disparo y uno óptico para la detección. La figura nos da una idea del experimento realizado. El artículo es éste.

La publicación de nuestro artículo ha pasado desapercibida para casi todos, pero no para Heimburg y Schneider, y esa fue la razón de que me hicieran la invitación. Querían conocer al profesor mexicano que había dado un paso más para probar la existencia de los solitones en membranas artificiales de lípidos.
No fue la mejor charla que haya dado en mi vida. Es más, fue la peor. Imagine el jetlag mortal después de volar de Monterrey a la Ciudad de México, luego a Paris, luego a Frankfurt y luego tomar un tren a Bonn y para terminar, con el viaje y mi cuerpo, otro de Bonn a Bad Honnef. Así que no dormí ese domingo por la noche por el cansancio y los nervios. Y el lunes me paré al frente a hacer el ridículo. Bueno, tal vez exagero. Siempre me va bien en mis charlas, pero sentí que esta vez no. Tengo un amigo colega que un día me platicó que le dio un ataque imparable de tos al momento de hablar en un congreso y no pudo dar nada. Por los nervios. Conmigo no fue para tanto, aunque debo decir que días antes de mi vuelo a Alemania me pegó un herpes zoster en la espalda. Saque usted sus conclusiones. Eso de somatizar solitones es algo fatal. Conclusión: por los nervios, por el jetlag, porque no había dormido y por pararme frente a un auditorio lleno de gente de alto calibre, me fue mal.
Al final del segundo día se organizó una round table sobre anestesia. Pasaron al frente Heimburg, Changeux y W. Hanke, un biofísico de la Universidad de Hohenheim, Alemania. Hablaron entre ellos como una hora, Heimburg defendiendo los solitones y el francés los potenciales. Changeux, aunque sin llegar a burla, se reía un poco de Heimburg. Luego dieron la palabra al público.
Y no dudé en intervenir, pues traía una espina clavada:
– Quiero traer al gas inerte xenón al ruedo. Profesor Changeux, si usted me explica con su teoría MWC cómo se ancla el xenón en una neurona para producir el efecto anestésico que produce, me hago alostérico.
Me vio sin interés, pero respondió:
– Xenon binds on GABA or NMDA. As simple as that. This is the way it inhibits the channels.
– No me responde sobre cuál es el mecanismo. Los farmacólogos y bioquímicos buscan por toda la librería de las moléculas conocidas aquella que sea la droga ideal. Con una potencia tal que pueda bastar un pico mol de sustancia para producir el efecto deseado. Y usan, porque no hay nada más bajo la luz del Sol, la fórmula que dice que la afinidad es el número “e” elevado al cambio negativo de la energía libre. Entre más negativo sea el cambio, más la potencia.
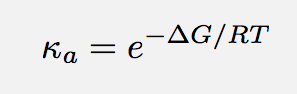
Eso dice su modelo, que el sistema ligando-target debe bajar lo que más pueda su energía libre. ¿Y qué hacen las industrias farmacéuticas si no encuentran una molécula? Pegan hidroxilos (OH’s) en donde se pueda. Así, la droga hace un puente de hidrógeno con un oxígeno o nitrógeno y se ancla a la proteína. Cuando se trata de hacer bien las cuentas, usan la termodinámica como se debe.
– Yes, we do – y le brillaron los ojos.
– Pero hagamos el cálculo completo. De la definición de energía libre, ésta se puede reducir disminuyendo la entalpía (H) o aumentando la entropía (S).
![]()
Los puentes de hidrógeno reducen la entalpía y ésa es la razón de que la interacción sea específica. ¿Pero dígame usted cómo hace el xenón para cambiar la entalpía si no tiene, ni se le puede añadir, un OH? La única forma es aumentando la entropía. Los antivirales para el SIDA han evolucionado mucho porque las farmacéuticas han probado decenas de caminos para liberarse de ese “molesto” efecto entrópico en la reducción de la energía libre. Pienso que con la anestesia las cosas son al revés, se busca liberarse del “molesto” efecto entálpico, puesto lo que importa es la entropía. Y por lo tanto, la anestesia debe ser vista como un fenómeno basado en interacciones no específicas.
Hemiburg acotó:
–Carlos tiene razón, el xenón no cambia la entalpía.
Changeux suspiró, y con autoridad dijo:
– Xenon binds onto a protein.
Después de la discusión, esa noche me senté a cenar en la mesa donde Israel Silman y su esposa comían. Silman me dijo: voy a wikipediar el sitio de acción del xenón, verás que es en una proteína. Su esposa y yo teníamos una interesante conversación sobre Amos Oz y Philip Roth, glorias de la literatura crítica judía. Pero le respondí a Silman: I believe xenon goes to the hydrofobic phase of the lipids.
El congreso fue un diálogo de sordos, entre miembros de dos tribus: una compuesta por el 99.99999 % de los neuro-científicos del mundo, la otra por unos cuantos rebeldes. La primera tiene el lenguaje dominante; la vida es compleja, el lenguaje es complejo y punto. La segunda tribu no tienen un lenguaje, sino algunas leyes. La palabra entropía, por ejemplo, no es una palabra más. Como lo es alostérico. Entropía es una variable termodinámica, parte de una teoría matemática que lleva siglos desarrollándose. Cuando Claudio Ptolomeo propuso su teoría del Sistema Solar, era tan obvia que no había duda: el Sol sale por el este y se mete por el oeste. Ergo, gira alrededor de la Tierra. Pasaron siglos para corregir el error.

Siempre se teoriza sobre lo que se ve, pero pocos lo hacen sobre lo que no se ve. Ernst Mach se burlaba de Boltzmann cuando le decía: ¿cómo puedes hacer una teoría abstracta sobre lo que no ves? (las moléculas que en la mente Boltzmann veía). Yo tengo la sospecha que por el bullying que le hizo Mach, el padre de la entropía se suicidó. Cuando Hodgkin y Huxley en 1952 vieron por vez primera en el osciloscopio un pulso eléctrico en un axón, les llegó la idea como una obviedad: los impulsos nerviosos son corrientes. E inmediatamente desarrollaron una teoría que las describe: la teoría del cable. Una teoría que salió de la evidencia, pero cargada de inconsistencias como pasa cuando se construye un primer modelo de lo que se ve.
Tasaki, un científico japonés en los 80, vio una protuberancia viajar en una neurona (junto con el pulso eléctrico) y supuso que además había una onda de sonido. La teoría del solitón de Thomas Heimburg la describe de una forma elegante y con leyes termodinámicas, donde las cosas caen en su lugar.
¿Pasarán siglos para saber qué modelo describe certeramente lo que pasa en el cerebro? ¿El potencial de acción produce la onda solitaria, o ésta produce al potencial de acción?