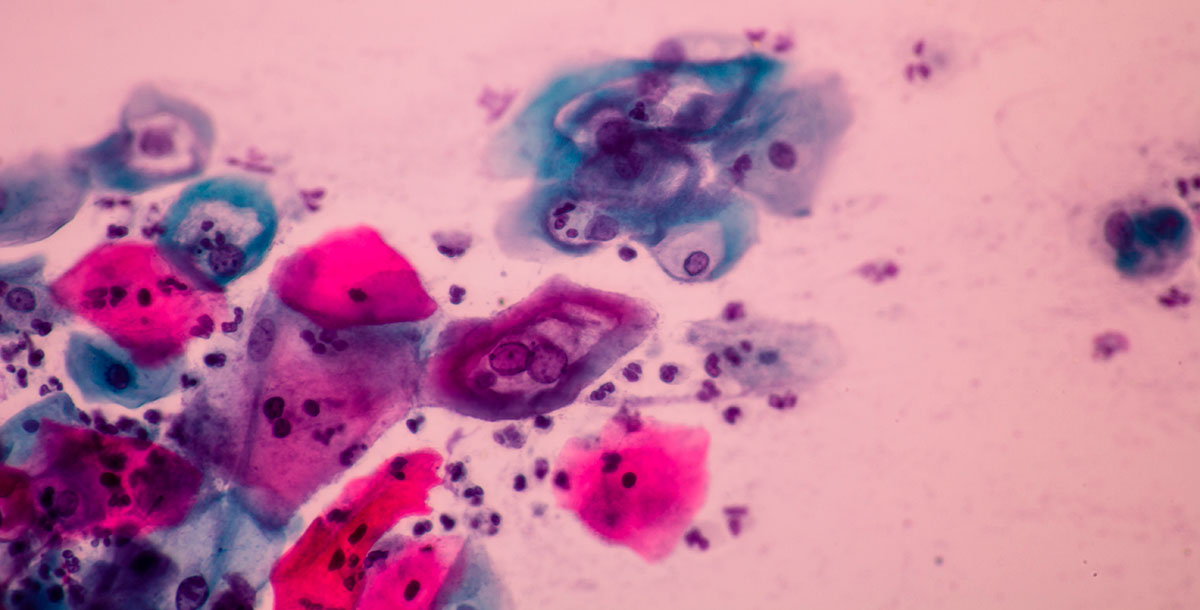
Los Papillomavirus son virus pequeños, con un genoma de doble cadena de ADN de aproximadamente 8000 pares de bases (pb). Se encuentran ampliamente distribuidos e infectan diversas especies, desde aves a mamíferos, incluyendo a los humanos. En general, infectan las células epiteliales y de las mucosas de su hospedero, producen lesiones hipertróficas del epitelio como verrugas y mezquinos. Los Papillomavirus penetran por lesiones pequeñas (micro-lesiones) hasta las células más indiferenciadas del epitelio (células basales del epitelio) y las infectan. Estas células tienen capacidad de dividirse y diferenciarse, por lo que en una célula basal infectada el virus se propaga a las células hijas que produce o a las células hijas que se diferencian; los Papillomavirus producen infecciones persistentes y poco productivas, es decir, generan pocas partículas virales que se liberan con las células epiteliales más diferenciadas, al ser eliminadas de la piel por descamación o por su recambio en las células de las mucosas.
Los Papilomavirus se asocian con el nombre de la especie que infectan, por ejemplo, Papillomavirus bovino, humano, aviar, etc. Se conocen aproximadamente 200 genotipos del Papillomavirus humano (HPV por las siglas de su nombre en inglés), y se acompañan de un número que designa a cada genotipo, por ejemplo HPV-1, HPV-16, HPV-18, etc. En México también se les conoce como: VPH-1, VPH-16, VPH-18 etc., por sus siglas en español. Algunos de los genotipos del HPV confieren un alto riesgo para cáncer cervicouterino y cáncer de la cavidad oral: cáncer de Laringe, de Faringe, del Paladar, de la Lengua etc., y se conocen como VPH de alto riesgo oncogénico, ejemplos son los HVP-16, HVP-18 y HVP-33. La mayoría de los HVP no confieren gran riesgo oncogénico (HPV de bajo riesgo) y sólo producen mezquinos y verrugas; algunos ejemplos son HPV-5, HPV-6, HPV-11, HPV-20, etc. El cáncer cervicouterino representa un grave problema de salud, cada año se producen medio millón de casos nuevos en el mundo y alrededor de 7000 en nuestro país. Desafortunadamente, el 50% de los casos no responden a los tratamientos combinados de quimio y radio terapia, por lo que la mitad de los afectados con este cáncer fallecen por mala respuesta al tratamiento.
Las lesiones hipertróficas de la piel que generan las infecciones de HPV, se producen porque el virus transforma de manera no maligna a las células infectadas. Una célula transformada es aquella que se propaga con una tasa de división más alta de lo normal, o en condiciones en las que no deba propagarse. Esto facilita que en las células de la cérvix se acumulen las mutaciones producidas por estímulos ambientales, por ejemplo, radiación, exposición a químicos o los compuestos del humo del cigarrillo. Los genes del HPV que son los principales responsables de la transformación celular, se conocen como oncogenes (ejemplos, los genes E6 y E7 de HPV-16). Los virus de alto riesgo oncogénico detectados más frecuentemente en cáncer cervicouterino son: HPV-16, HPV-18 y HPV-33. Es aceptado, que el nivel de riesgo oncogénico se basa en la capacidad de sus oncogenes E6 y E7 para unirse a las proteínas celulares que son su blancos: las proteínas P53 y RB. Ambas proteínas controlan la muerte celular programada y la división celular, respectivamente. Destaca que el HPV-16 se detecta hasta en 60% de los tumores de cérvix (se considera el tipo viral con mayor riesgo oncogénico), y esto se correlaciona con su capacidad de producir un mayor número de transcritos alternativos por splicing de sus oncogenes E6/E7.
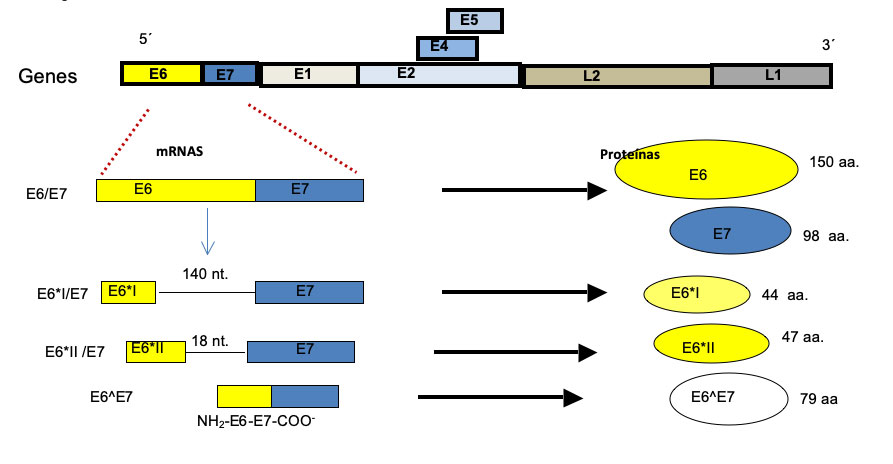
Los ácidos ribonucleicos mensajeros (mRNAs, por su siglas en inglés) de virus de alto riesgo oncogénico se transcriben como RNAs policistrónicos (o transcritos policistrónicos) y se procesan por splicing (en español se traduce como corte y empalme). Un policistrón puede codificar varios genes en su RNA. Todos los transcritos policistrónicos de HPV son procesados por splicing. En el caso del cáncer cervicouterino, los genes que se expresan principalmente son los oncogenes E6/E7, los responsables de la transformación celular. Los transcritos de los oncogenes E6 y E7 de los virus de alto riesgo oncogénico se procesan por splicing, el transcrito policistrónico se llama E6/E7, mientras que los de los virus de bajo riesgo no se procesan por splicing. Los mRNAs de los oncogenes E6/E7 del HPV-16, producen 4 formas al ser procesados por splicing (Fig.1), mientras que los mRNAs de los oncogenes de otros virus de alto riesgo (por ejemplo HPV-18), sólo producen 2 formas de mRNA por splicing. El resultado del splicing es que se producen la oncoproteína E7 y 4 formas de la oncoproteína E6, la proteína completa y 3 formas cortas en el caso de HPV-16 y sólo 2 formas en HPV-18. El trabajo en mi laboratorio inició con esa interesante observación y nos preguntamos “¿puede contribuir con un mayor riesgo oncogénico la capacidad de los oncogenes de E6/E7 de HPV-16 para producir un mayor número de formas de sus transcritos? Los resultados publicados y no publicados de nuestro grupo sugieren que el splicing de los oncogenes E6/E7, participa en parte, y puede generar diversidad en los tumores de cáncer cervicouterino, como se explica a continuación.
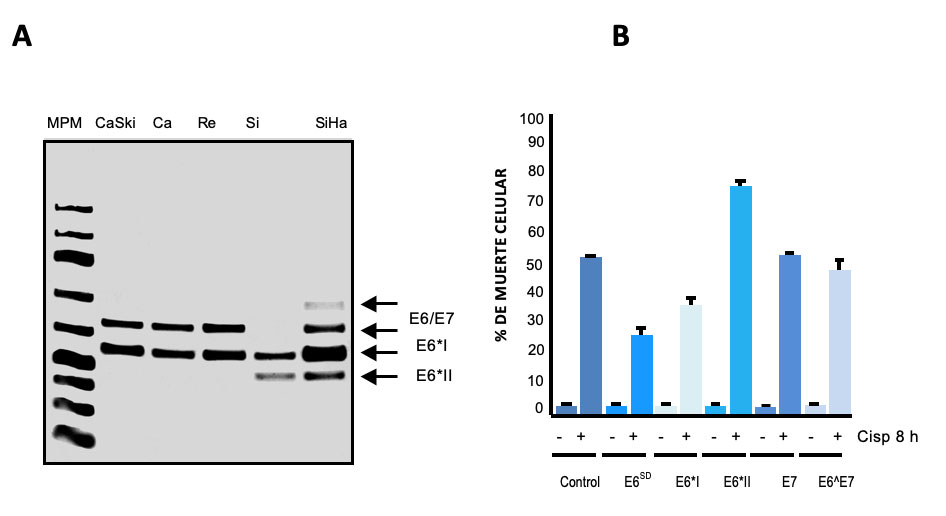
Una observación interesante de otros laboratorios y el nuestro, es que los tumores expresan de manera heterogénea las 4 formas de los transcritos de E6/E7 de HPV-16 y esto mismo se observa en las líneas celulares derivadas de tumores de cerviz que contiene HPV-16 (Fig. 2A). El resultado de esta expresión heterogénea de mRNAs, es que se pueden producir diferentes niveles de las formas de la proteína oncogénica de E6 en los tumores y también en líneas celulares derivadas de los tumores. De manera intrigante, los tumores de diversos tipos de cáncer son heterogéneos y esto también ocurre en los tumores de cérvix. Es decir, los tumores presentan diferencias importantes (de expresión) entre pacientes y aun en el mismo paciente, cuando hay varios focos del tumor. Las diferencias pueden ser de expresión en algunas proteínas e incluso en mutaciones y re-arreglos genéticos, esta característica les confiere propiedades importantes a los tumores, lo que les permite tener una capacidad selectiva y adaptativa de supervivencia a las células tumorales, e incluso adquirir propiedades de resistencia a los tratamientos quimio- y radio-terapéuticos. Por ellos, nos preguntamos si la expresión heterogénea de los transcritos de E6/E7 de HPV-16, es un reflejo de la diversidad de los tumores de cáncer cervical, o viceversa, la heterogeneidad de expresión de las diferentes formas de los oncogenes E6, contribuye a la diversidad tumoral. La respuesta parece ser compleja y hay contribución de varios factores, por ejemplo, la variación en los niveles de varias de las proteínas celulares que se unen al mRNA, los cambios en los niveles de expresión de las diferentes formas de la oncoproteína E6, y las formas diferentes de esta proteína, que pueden a su vez tener diferentes consecuencias en los mecanismos de resistencia a la apoptosis, un tipo de muerte celular programada, lo que trae como consecuencia una respuesta diferencial a diversos medicamentos quimio-terapéuticos. Estos agentes quimio-terapéuticos inducen apoptosis en las células de cáncer. Desafortunadamente, la mitad de las pacientes de cáncer cervicouterino finalmente fallecen (la vida a 5 años después del diagnóstico, es de 50-60%) por mala respuesta al tratamiento, y porque los tumores resurgen más agresivos y producen nuevos focos e incluso metástasis a otros tejidos.
Cada una de las formas de splicing alternativo del oncogen E6 contribuye diferencialmente a la resistencia a la apoptosis, Lo anterior lo demostramos al introducir (por transfección) cada una de las formas de splicing del oncogen E6 ( contenidas c/u en un plásmido) en una línea celular de cáncer cervicouterino libre de HPV (Fig.2 B). Sin embargo, la participación del oncogen E6 en apoptosis es complejo, ya que como se mencionó afecta la función y niveles de expresión del proteína P53 y también es capaz de unirse o afectar la expresión de varios factores importantes para la apoptosis celular, como son el receptor del factor de necrosis tumoral (TNFR1) y algunas proteínas asociadas a este receptor llamadas FADD, TRAF3, Caspasa-8 o de las proteínas inhibidoras de la apoptosis como: BCl2 y cIAPs 1 y 2. Aún se requiere mucho trabajo de investigación para comprender mejor la participación de las formas alternativas de la oncoproteína de E6 en la heterogeneidad tumoral , específicamente en los mecanismos de resistencia a la apoptosis.
Raul Bonilla-Moreno, Carolina Vaisman, Israel Garcia Aguiar, Norberto Ivan Bautista Gaytán, Remberto Conde-Campos y Nicolas Villegas-Sepulveda.
Departamento de Biomedicina Molecular Centro de Investigación y de Estudios Avanzados-IPN