En 2008, el mundo de la moda se vistió de luto tras la pérdida de uno de los genios en alta costura, el francés Yves Saint-Laurent, quien perdió la lucha contra el glioblastoma. Otra víctima de este tipo de neoplasia (masa anormal de tejido) fue Celia Cruz, cantante cubana-estadounidense de música tropical, apodada “La reina de la salsa”. Según la American Brain Tumor Association, el glioblastoma es cualquier tumor que se forme en las células gliales (“pegamento del cerebro”), que se ubica entre las neuronas y las mantiene unidas (Figura 1).
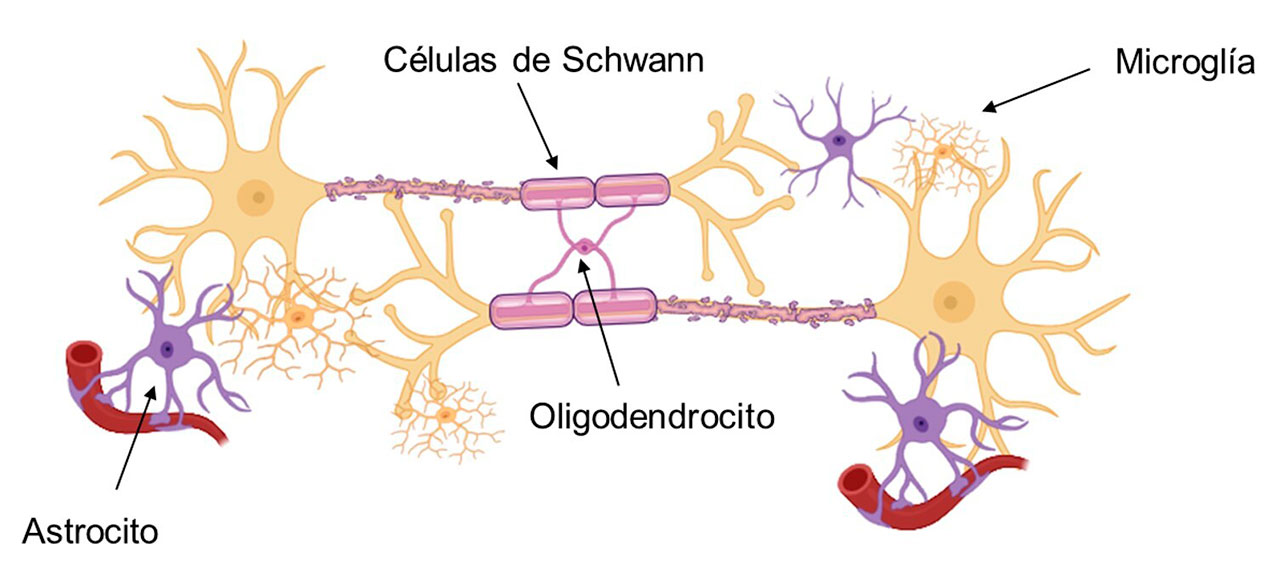
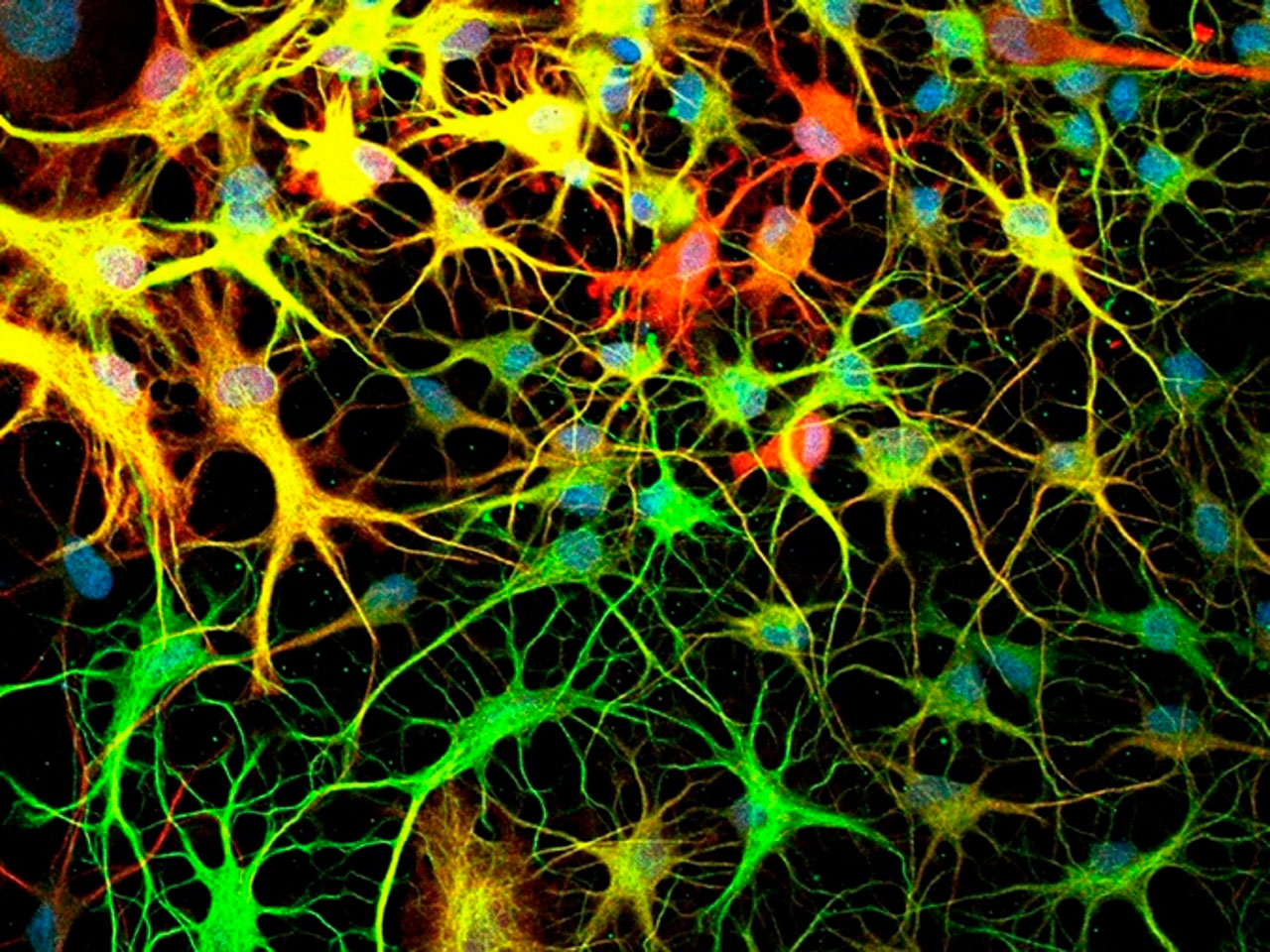
Los astrocitos (Figura 2) son las células que predominan por abundancia en el Sistema Nervioso Central (SNC) y se encuentran íntimamente relacionadas con las neuronas, proporcionan soporte estructural definiendo límites celulares, contribuyen a la formación de la barrera hematoencefálica, circundan las uniones sinápticas y cumplen funciones fisiológicas importantes como el control de la formación y función sináptica, la neurogénesis y la regulación del tono vascular del cerebro. Cuando existe un daño en el SNC los astrocitos secretan factores tróficos, dando paso al proceso conocido como gliólisis, que consiste en la formación de una red extensa y gruesa de astrocitos (cicatriz de astrocitos) (Martínez, 2014).
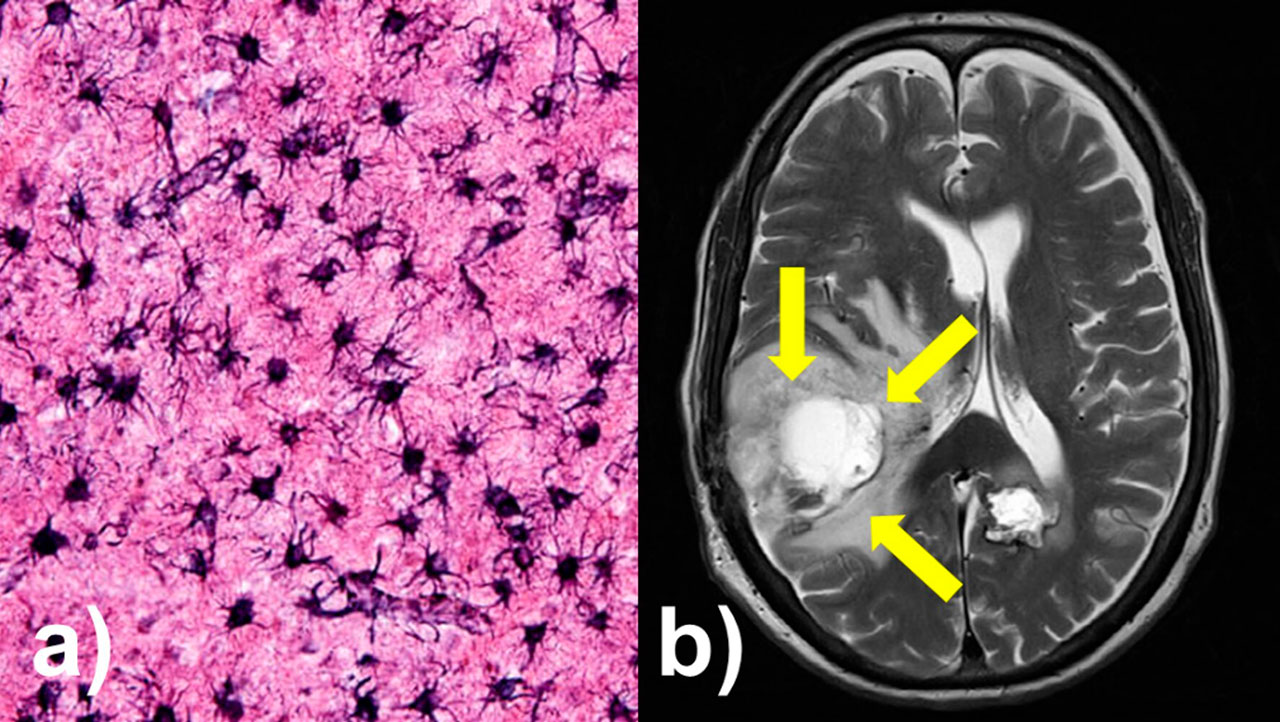
Un tipo de glioma es el astrocitoma. Los astrocitomas toman su nombre de los astrocitos, las células en forma de estrella de las cuales crecen (Figura 3a). Los astrocitomas se clasifican por grado para describir su nivel de gravedad, el cual va entre una escala de I a IV. El glioblastoma (Figura 3b) es el grado más alto de los astrocitomas, grado IV y es la forma más maligna, además, tiene la tasa de supervivencia más baja de todos los cánceres cerebrales. Las características histológicas que distinguen a los glioblastomas de todos los demás grados son la presencia de necrosis (células muertas) y el aumento de vasos sanguíneos alrededor del tumor. Los tumores de grado IV siempre crecen rápidamente y son extremadamente malignos.
La denominación multiforme de los glioblastomas está dada por la heterogeneidad que lo caracteriza por medio de la microscopía; éstos se clasifican clínicamente en glioblastoma primario (GBM 1) y glioblastoma secundario (GBM 2). La biología molecular de los glioblastomas está altamente relacionada con el equilibrio de la expresión de proteínas que regulan positiva o negativamente el ciclo celular, la proliferación, la mortalidad, la angiogénesis y el reconocimiento del sistema inmunológico. Estos fenómenos resultan de cambios en los niveles de expresión de genes normales o de la pérdida de su expresión.
En el caso del GBM 1 es notable la mutación y sobreexpresión de los genes EGFR y MDM2, además de la eliminación de la proteína p16 y la pérdida de la heterocigosidad (pérdida de una copia de un gen) del cromosoma 10q. En el caso de GBM 2 se destaca la sobreexpresión de PDGF/PDGFRa, la pérdida de heterocigosidad del cromosoma 19q y las mutaciones de los genes IDH1/2 y PT53. Según el metaanálisis de datos del “The Cancer Genome Atlas” el GBM se subdivide en 4 subtipos diferentes según las alteraciones génicas que presentan: proneural (PDGFR), neural (IDH1/2), mesenquimal (NF1) y clásico (EGFR) (Reséndiz-Castillo et al., 2022).
Cuando existe una sobreexpresión de proteínas como la IL13RA2, NG2, BIRC3, Nrf2 y p62 se atribuyen a GBM más agresivo y a un mal pronóstico de la enfermedad, mientras que la sobreexpresión de proteínas como Tau, Parkin y Pink 1 son relacionadas con un mejor pronóstico puesto que controlan la proliferación tumoral mediante el ciclo celular.
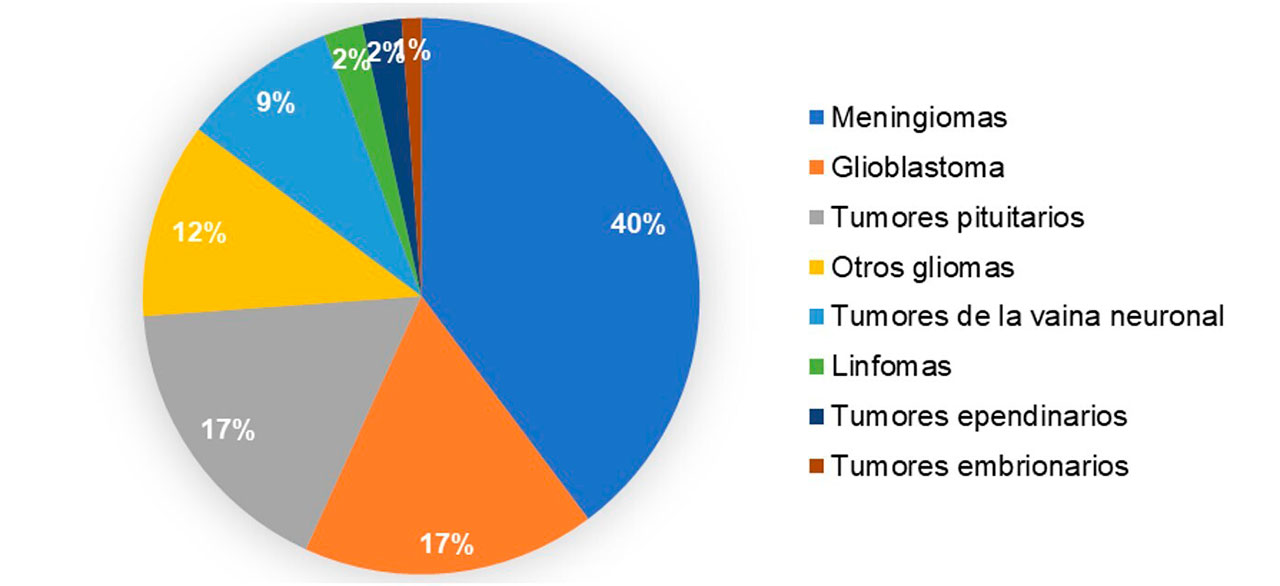
En general, el pronóstico para los pacientes con esta enfermedad es adverso, con una mediana de supervivencia de <2 años. Se ha observado que los diagnósticos desfavorables tienen un ligero predominio en el sexo masculino y la incidencia aumenta según la edad (Tan et al., 2020). Los tumores más frecuentes en la edad pediátrica son el astrocitoma pilocítico, los tumores embrionarios y los gliomas malignos; mientras que en los adultos se encuentran los meningiomas, los tumores pituitarios y los gliomas malignos (Figura 4) (Gómez Vega et al.,2019).
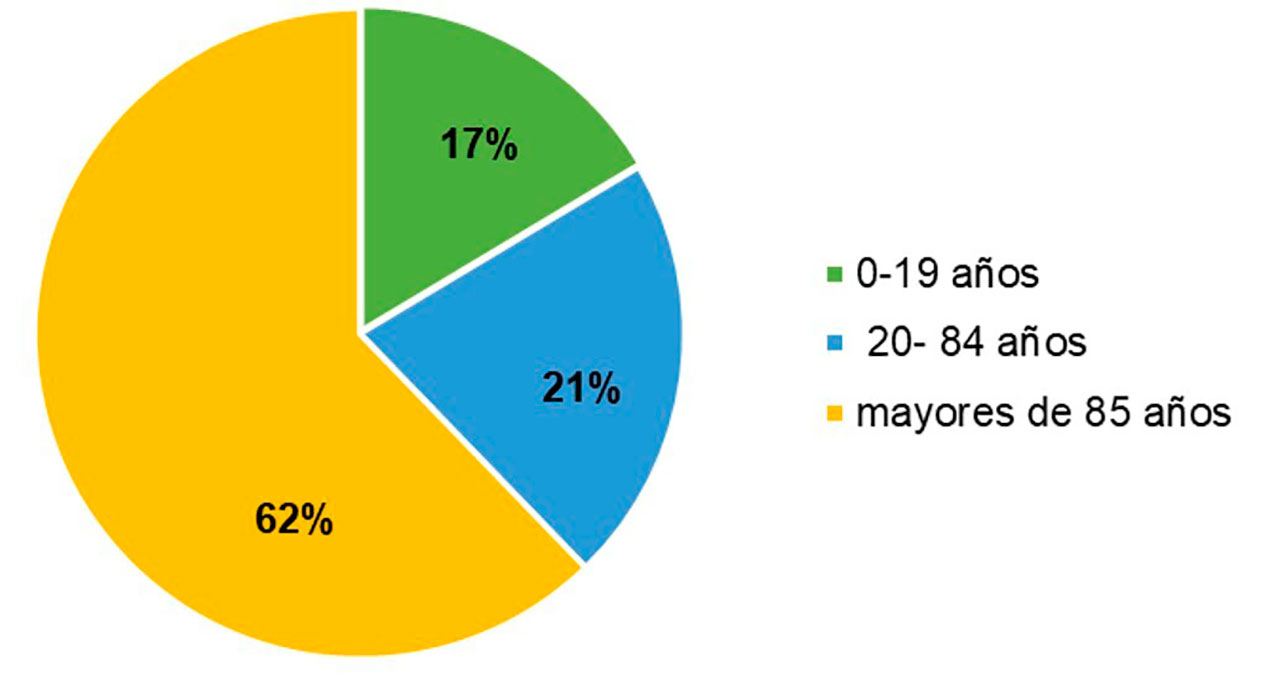
En el mundo, cada año se diagnostican cerca de 300 mil nuevos casos, que corresponden al 2.5 % de la mortalidad por cáncer. La incidencia total de tumores cerebrales primarios (Figura 5) corresponde a 21.42 por 100,000 habitantes, siendo de 5.42 por 100,000 habitantes en pacientes entre 0 y 19 años, de 27.85 por 100,000 en pacientes de más de 20 años y mayor en pacientes mayores de 85 años (81.16 por 100,000 hab.) (Contreras, 2017).
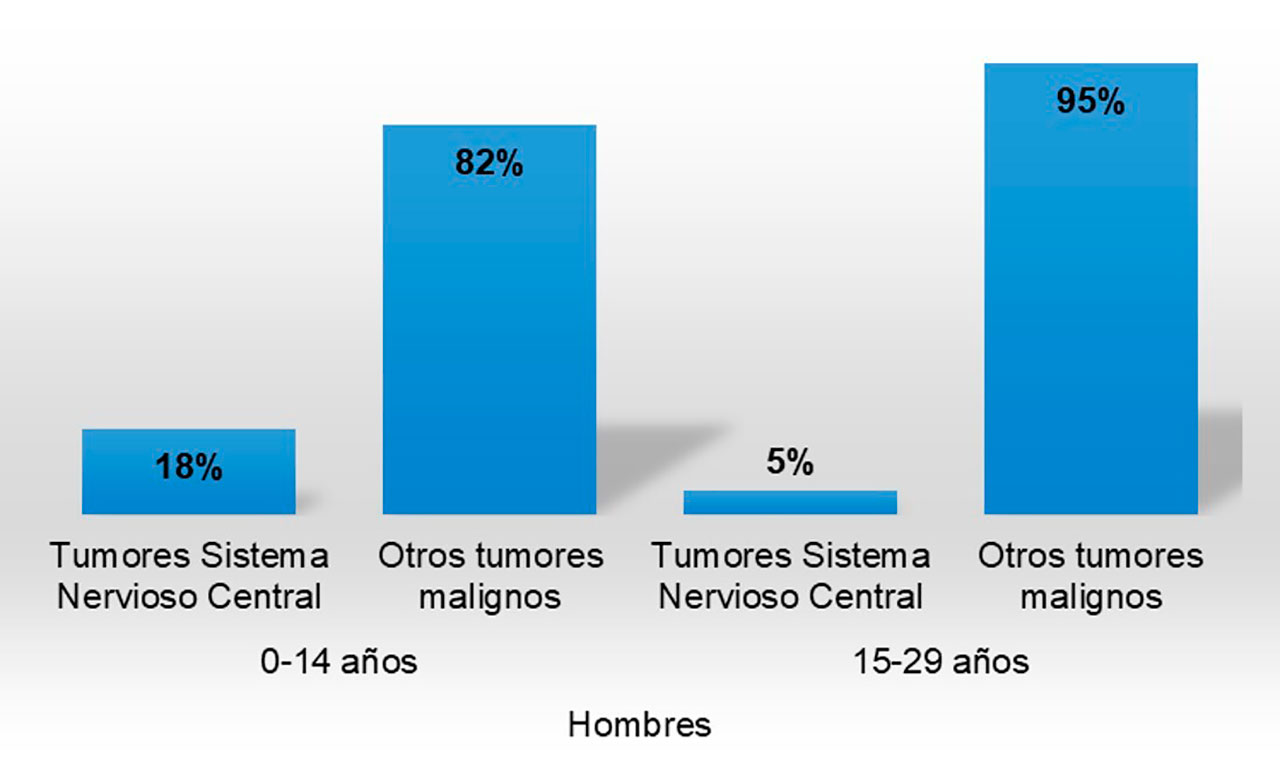
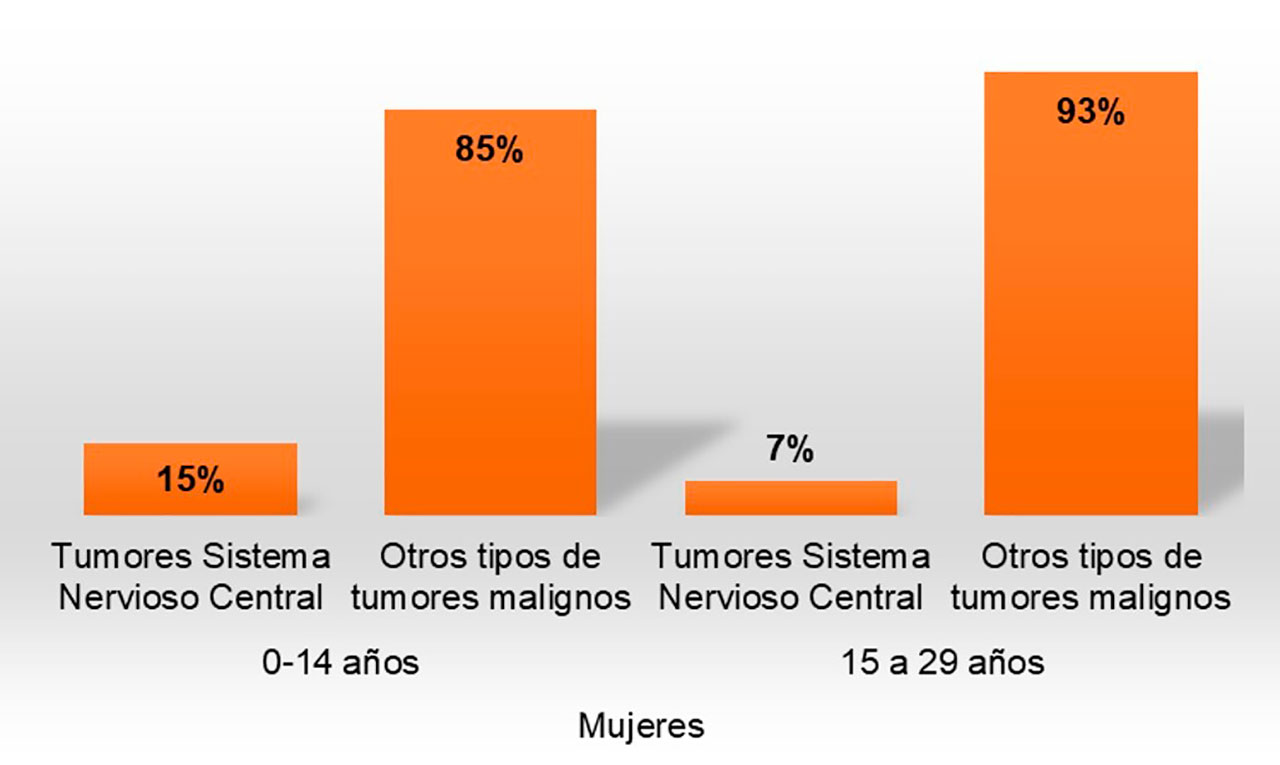
En México no hay mucha información acerca de la incidencia y prevalencia de estas neoplasias, aunque, en el 2019 el INEGI informó sobre el porcentaje de defunciones. En hombres la prevalencia es del 18% en grupos entre 0 a 14 años y 5% para grupos entre 15 a 29 años (Figura 6a); mientras que en mujeres es de 15% para grupos entre 0 a 14 años y 7% en grupos entre 15 a 29 años (Figura 6b). Instituto Nacional de Estadística y Geografía (INEGI, 2021).
Un estudio realizado por investigadores de los institutos nacionales de Cancerología, Neurología y Neurocirugía, y de la Universidad de Guadalajara, indica que el 90% de 155 pacientes mexicanos con este tipo de cánceres tuvo una sobrevida menor a 15 meses. Sólo el 9% alcanzó dos años y el resto tres años (González, 2020).
Se sabe que el glioblastoma se origina en una célula madre, pero los factores de riesgo que provocan que este tipo de células lleguen a ser malignas aún se desconocen. Los signos y síntomas de esta enfermedad se presentan inicialmente como incapacidad o dificultad de comunicarse mediante el habla, la escritura o la mímica. De igual manera la epilepsia precede al diagnóstico inicial de glioblastoma entre el 24-68% de los pacientes y se desarrolla en un 19-38 % más tarde durante el curso de la enfermedad (Wirsching et al., 2016).
A pesar de que el pronóstico de esta enfermedad es negativo, algunas terapias convencionales pueden elevar la calidad de vida de los pacientes. Sin embargo, se ha visto que la intervención de la quimioterapéutica actual con temozolomida (TMZ), en conjunto con radioterapia y la resección quirúrgica, no es muy efectiva ya que el glioblastoma cuenta con una compleja red vascularizada que desvía la entrada de estos fármacos, aunado a que la barrera hematoencefálica favorece la farmaco-resistencia (Thakur et al., 2022).
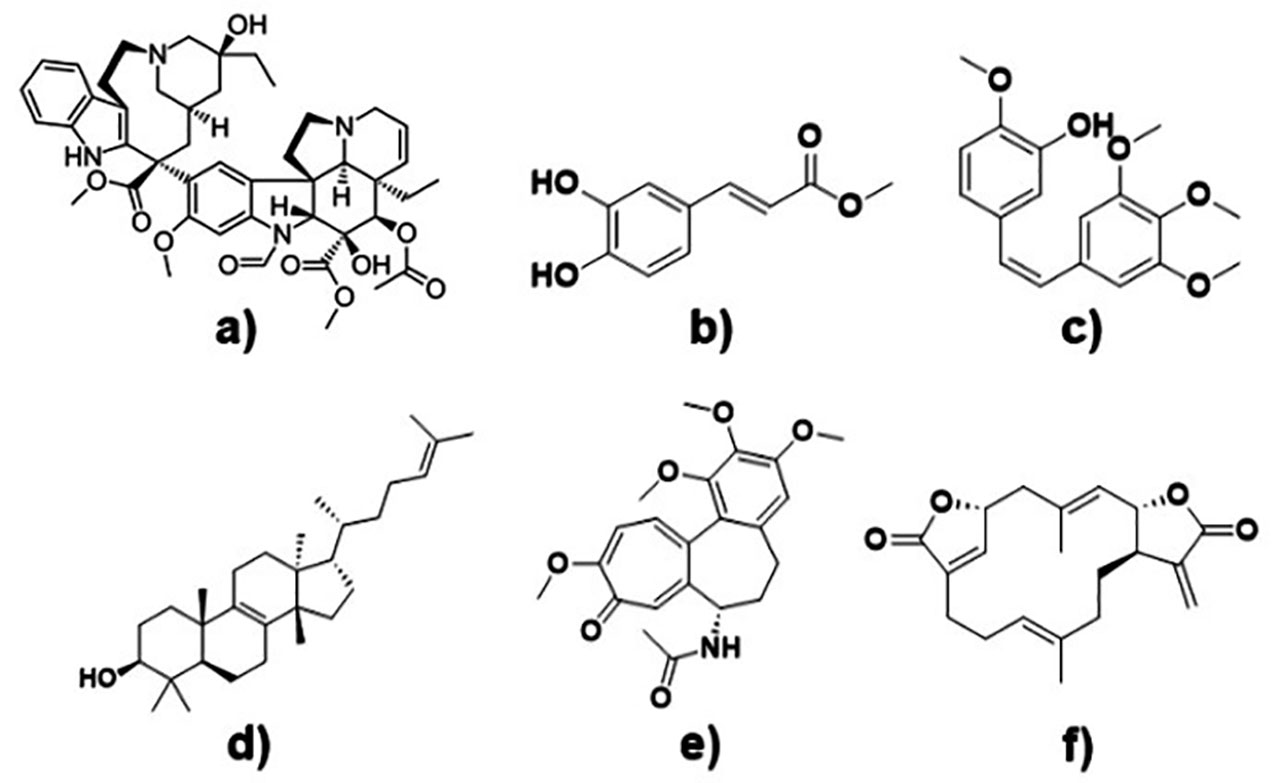
Hoy en día se sabe que las plantas medicinales siguen siendo prometedoras para la obtención de nuevas moléculas contra el cáncer. Por ejemplo, entre las plantas tenemos a Catharanthus roseus, Colchicum autumnale, Abutilon indicum, Euphorbia tirucalli, Anisomeles indica y Combretum caffrum (Figura 7), de las cuales provienen moléculas como la vincristina, colchicina, cafeato de metilo, euphol, ovatodiolida y combretastatina A4 (Figura 8). Estos compuestos pueden penetrar la barrera hematoencefálica gracias a sus propiedades lipofílicas y su peso molecular, favoreciendo que se dirijan a las células cancerosas y promoviendo varias proteínas inmunológicas y anti proliferativas para prevenir una mayor propagación del tumor y activar la muerte de las células tumorales (Shah et al., 2020). Aunque existe evidencia de resultados favorables en investigaciones in vitro e in vivo, aún falta generar más información que permitan conocer su efectividad y seguridad, en especial en el uso de plantas medicinales, por lo que aún no se recomienda su uso en los humanos.

Un estudio realizado en 2016 por Hsieh y colaboradores demostró que la ovatodiolida extraida de Anisomeles indica, ejerce un potencial anticancerígeno en líneas celulares de cáncer de páncreas a través de la regulación de STAT3 Y NF-ΚB. Este analíto mostró efectos de citotoxicidad en las células de cáncer de páncreas al inhibir la proliferación celular e inducir la apoptosis. Se suprimió notablemente la adhesión y la invasión celular de una manera dependiente de la dosis, la expresión de ARNm de la metaloproteinasa de matriz-9 (MMP-9) y la quinasa de adhesión focal (FAK) disminuyó significativamente (Hsieh et al., 2016).
El análisis de transferencia Western indicó que la ovatodiolida suprimió potentemente la fosforilación de STAT-3 y su quinasa, incluidas ERK1/2, P38 y AKT Ser473. Además, inactivó el factor nuclear kappa B (NF-kB) al inhibir la activación de la quinasa IκB (IKK α/β) y la posterior supresión de la fosforilación del inhibidor de kappa B (IκB). Estos resultados demostraron que la ovatodiolida podría potencialmente inhibir la proliferación de células cancerosas Mia-PaCa2 e inducir la apoptosis mediante la modulación de la vía NF- κ B y STAT3. También, interfirió con la adhesión a la matriz celular en células cancerosas MIA-PaCa2 (células de cáncer pancreático) al reducir la transcripción de MMP-9 y FAK mediante la supresión de la vía NF-κB y STAT3 (Hsieh et al.,2016).
Por tanto, la ovatodiolida se muestra como potencial agente anticancerígeno para GBM, ya que muestra actividad del factor nuclear κB (NF-κB) que se ha asociado con la formación y el crecimiento de tumores y una mayor resistencia a la terapia (Avci et al., 2020). Aunado a esto, STAT3 ha sido identificado como un factor de resistencia a TMZ, radiación y bevacizumab. De esta manera, tanto NF-κB como STAT3, se han caracterizado como los principales impulsores del GBM (Kenneth Gray et al., 2014).
En conclusión, el glioblastoma es uno de los cánceres más agresivos y con menos probabilidad de remisión. Por ello es imperativo seguir con la investigación tanto de los mecanismos moleculares de génesis de los tumores, así como de nuevos tratamientos que ayuden por lo menos a prolongar el tiempo de vida de los pacientes de la mano con una buena calidad de vida. Una cantidad de terapias novedosas ha mostrado signos prometedores de eficacia incluyendo el uso de plantas medicinales. Cabe señalar que se deben tomar en cuenta los estudios clínicos, para obtener tratamientos para los pacientes con este cáncer agresivo. En consecuencia, la comunidad científica tiene una ardua tarea para investigar la seguridad, eficacia y toxicidad de los compuestos que puedan ayudar a combatir el glioblastoma.
Referencias
- Avci, N. G., Sadaf Ebrahimzadeh-Pustchi, Akay, Y. M., Esquenazi, Y., Tandon, N., Zhu, J., & Metin Akay. (2020). NF-κB inhibitor with Temozolomide results in significant apoptosis in glioblastoma via the NF-κB(p65) and actin cytoskeleton regulatory pathways. Scientific Reports, 10(1). https://doi.org/10.1038/s41598-020-70392-5
- Contreras, L. (2017). EPIDEMIOLOGÍA DE TUMORES CEREBRALES. Revista Médica Clínica Las Condes, 28(3), 332–338.
- Isasi, E. Facultad de Medicina- UdelaR. Astrocitos reactivos | Histología y Embriología. (2023). Histología Y Embriología. http://www.histoemb.fmed.edu.uy/node/107
- Gómez-Vega, J.C., Ocampo, I., & Oscar Feo Lee. (2019). Epidemiología y caracterización general de los tumores cerebrales primarios en el adulto. Universitas Médica, 60(1). https://www.redalyc.org/journal/2310/231057460010/html/#redalyc_231057460010_ref2
- González, A. (2020). Al año, diagnostican 300 mil nuevos casos de tumores cerebrales en el mundo. Boletín UNAM-DGCS-580. https://www.dgcs.unam.mx/boletin/bdboletin/2020_580.html
- Hernández, F., Martínez V., & Rey, J. A. (2007). Biología molecular de los glioblastomas. Neurocirugía, 18(5). https://doi.org/10.4321/s1130-14732007000500001
- Instituto Nacional de Estadística y Geografía (INEGI). (2021). Instituto Nacional de Estadística y Geografía. (2015). Estadísticas “A Propósito Del Día Mundial Contra El Cáncer (4 de febrero). https://www.inegi.org.mx/contenidos/saladeprensa/aproposito/2021/cancer2021_Nal.pdf
- Kenneth Gray, G,, McFarland, B. C., Nozell, S. E., & Benveniste, E. N. (2014). NF-κB and STAT3 in glioblastoma: therapeutic targets coming of age. Expert Review of Neurotherapeutics, 14(11), 1293–1306. https://doi.org/10.1586/14737175.2014.964211
- Martínez Gómez, A. (2014). Comunicación entre células gliales y neuronas II. células gliales que forman mielina. http://hdl.handle.net/20.500.11799/49599
- Reséndiz-Castillo, L.J., Minjarez-Vega,B., Reza-Zaldívar, E. E., Hernández-Sapiéns, M. A., Y.K. Gutiérrez-Mercado, & Canales-Aguirre, A. A. (2022). Efecto de la alteración de los niveles de expresión de microARN neurogénicos y su implicación en la agresividad de glioblastomas localizados en la región paraventricular. Neurología, 37(9), 781–793. https://doi.org/10.1016/j.nrl.2019.07.005
- Shah, F. H., Ali, J., Idrees, J., Idrees, F., Shah, S. A. A., Khan, A., & Ahmad, B. (2020). Current Progress of Phytomedicine in Glioblastoma Therapy. Current medical science, 40(6), 1067-1074. https://doi.org/10.1007/s11596-020-2288-8
- Tan, A. C., Ashley, D. M., López, G. Y., Malinzak, M., Friedman, H. S., & Khasraw, M. (2020). Management of glioblastoma: State of the art and future directions. CA: a cancer journal for clinicians, 70(4), 299–312. https://doi.org/10.3322/caac.21613
- Thakur, A., Faujdar, C., Sharma, R., Sharma, S., Malik, B., Nepali, K., & Liou, J. P. (2022). Glioblastoma: Current status, emerging targets, and recent advances. Journal of Medicinal Chemistry, 65(13), 8596-8685. https://doi.org/10.1021/acs.jmedchem.1c01946
- Wirsching, H. G., Galanis, E., & Weller, M. (2016). Glioblastoma. Handbook of clinical neurology, 134, 381–397. https://doi.org/10.1016/B978-0-12-802997-8.00023-2












