En los organismos multicelulares, las células de un mismo tipo se agregan y forman tejidos. En los animales, los tejidos que constituyen la frontera entre el individuo y el medio externo, forman capas de células conocidas como epitelios. Las células epiteliales tienen dos caras con morfología y composición bioquímica diferente: una, denominada apical, se orienta hacia el exterior del organismo o a la luz de cavidades y ductos, y otra, llamada basolateral, hacia el interior. Los epitelios permiten la formación en el organismo, de compartimentos con diferentes contenidos (e.g. leche, orina, sangre, heces, etcétera), lo que es indispensable para al desarrollo de órganos complejos como el hígado, los riñones, el intestino, etcétera.
Los epitelios regulan el paso de iones y moléculas por dos vías: la transcelular, donde las substancias atraviesan las células por medio de canales, bombas y acarreadores, y la paracelular, en la que los iones y moléculas transitan por el espacio lateral entre las células, regulado por las uniones estrechas. Estas últimas son estructuras de contacto célula-célula ubicadas en la porción superior de la membrana lateral, en el límite con la membrana apical.
La unión estrecha tiene dos funciones canónicas. La primera es la de actuar como cerca que bloquea en el plano de la membrana, el flujo de lípidos y proteínas entre las membranas apical y basolateral, para mantener así polarizada la membrana plasmática. La segunda función de la unión estrecha es de compuerta, y para ello forma poros o canales paracelulares que regulan con base en la carga el paso de iones y en función del tamaño el tránsito de macromoléculas.
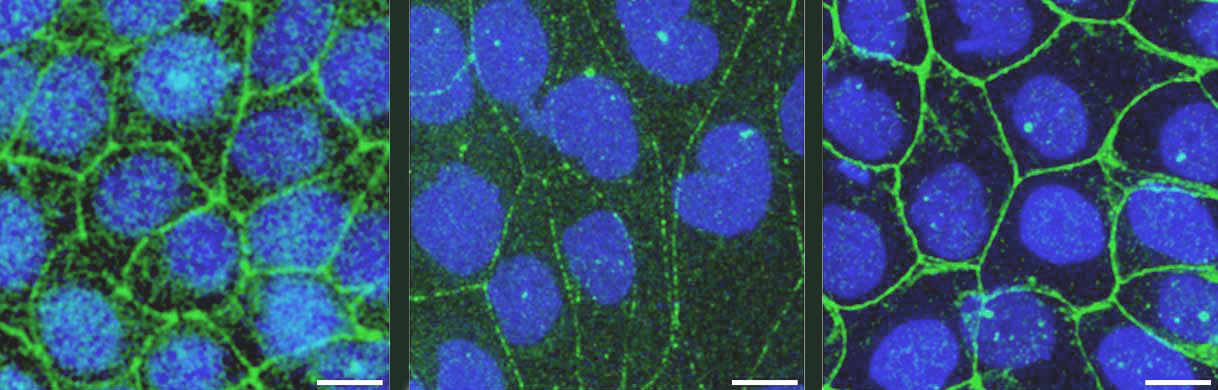
A nivel molecular, la estructura de las uniones estrechas es compleja, pues involucra tanto a proteínas transmembranales que se adhieren entre sí en el espacio intercelular y que forman a los poros paracelulares (e.g. claudinas), como a proteínas intracelulares como las Zonula Occludens (ZO), que funcionan como puentes entre el citoesqueleto de actomiosina y las proteínas transmembranales de la unión estrecha (Fig. 1). El citoesqueleto de actomiosina forma, en el límite entre las membranas apical y lateral, un cinturón integrado por filamentos paralelos de actina con segmentos regulares de miosina que asemejan a un mini sarcómero (Fig.1). ZO-1 y ZO-2 tienen, en su primera mitad, múltiples dominios que les permiten asociarse a las diferentes proteínas integrales de las uniones estrechas (claudinas, JAM-A y ocludina), y en su segmento carboxilo poseen una región de unión a actina.
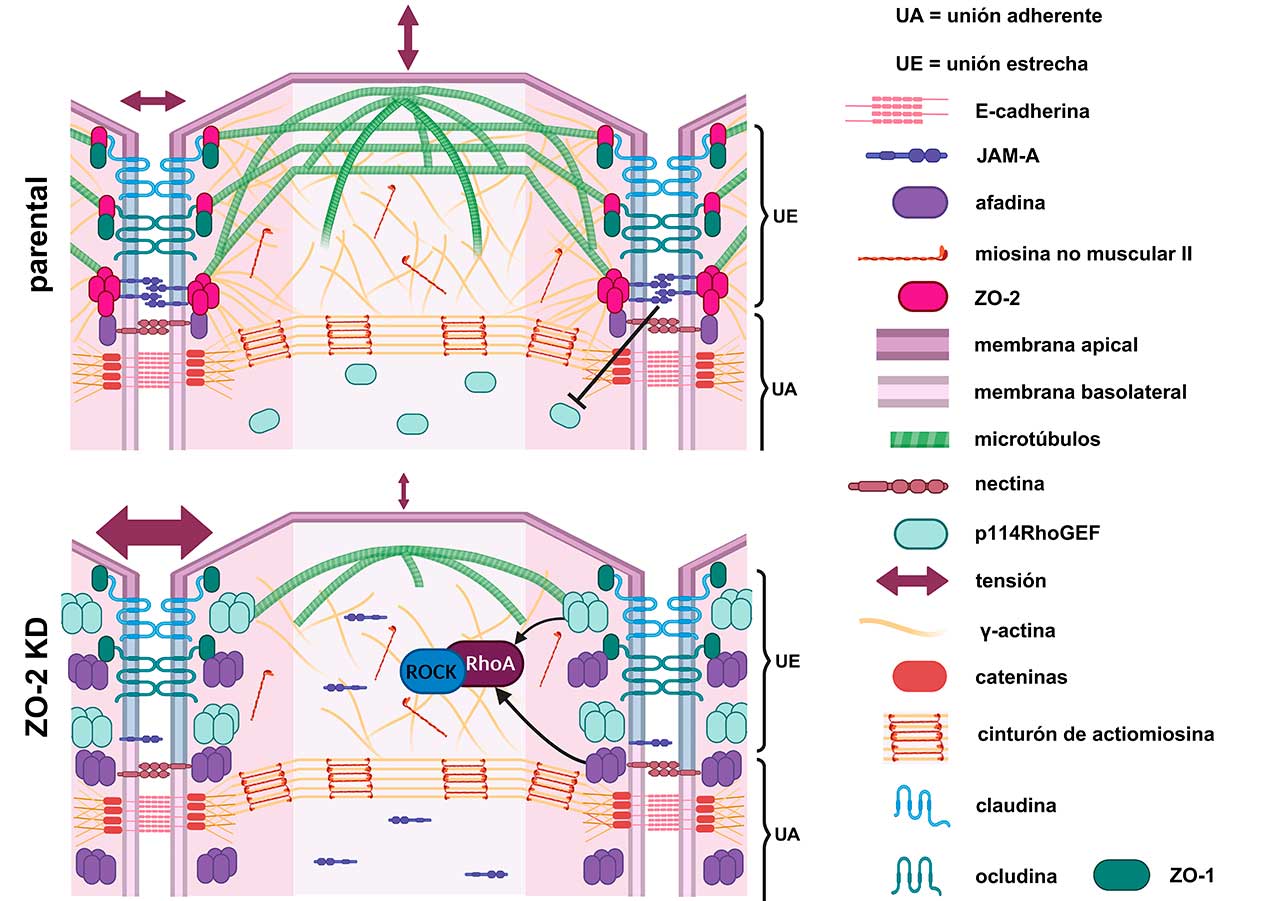
Para formar los poros paracelulares, las claudinas deben de polimerizarse, y ello requiere una plataforma de proteínas ZO-1 y ZO-2 multimerizadas. Para que esto suceda, las proteínas ZOs tienen que adquirir una conformación estirada, lo que solo sucede si el citoesqueleto de actomiosina se une a las proteínas ZOs y las tensa. Por ello, estudiamos el papel de ZO-2 como transductor de la tensión mecánica en las células epiteliales.
Trabajamos con una línea estable de células epiteliales renales MDCK en las que se eliminó la expresión de ZO-2 (ZO-2 KD). Primero analizamos si la falta de ZO-2 altera la rigidez de la membrana apical. Para ello, nanoindentamos con un microscopio de fuerza atómica, la superficie apical de las células MDCK parentales y ZO-2 KD. Este experimento se basa en el principio de que la fuerza que restaura la deformación originada por la nanoindentación refleja la tensión de la membrana apical. Así, encontramos que la rigidez de la membrana apical (en valores del módulo de Young) disminuye en ausencia de ZO-2. Para explicar por qué disminuye la rigidez apical, analizamos el estado del citoesqueleto en esta región, constituido por una red de microtúbulos y filamentos ramificados de actina (Fig. 1). Por una parte, sabíamos que en las células ZO-2 KD desaparece de la región de la unión estrecha, el anillo de microtúbulos al que se ancla el domo de microtúbulos apicales. Entonces, en las células ZO-2 KD, estabilizamos a los microtúbulos con docetaxel y encontramos que se recuperaba la tensión de la membrana apical. Esto demostró que la tensión apical depende del anclaje de los microtúbulos apicales a la unión estrecha y que esto no sucede cuando falta ZO-2.
Por otro lado, se sabe que las células epiteliales expresan β-actina y γ-actina, y que ésta última se concentra debajo de la membrana apical. Encontramos que la unión de γ-actina a la unión estrecha depende de ZO-2, por lo que concluimos que la disminución de la tensión apical en las células ZO-2 KD también se debe a que en estas células falla el reclutamiento de la γ-actina a las uniones estrechas.
El siguiente paso fue analizar si la falta de ZO-2 altera la tensión mecánica de las uniones estrechas. Para ello empleamos como sensor de la tensión a ZO-1 con un módulo de FRET o de transferencia de energía por resonancia de fluorescencia. El FRET se basa en el hecho de que un fluoróforo como el CFP, cuando se excita, puede transferir parte de su energía a una molécula aceptora como el YFP. Así, en las células parentales y ZO-2 KD introdujimos una construcción de ZO-1 que tiene en su parte media a los módulos CFP y YFP conectados con una liga elástica derivada de las telarañas. De esta manera, si no hay tensión, los módulos CFP y YFP quedan cercanos el uno del otro y hay FRET. En cambio, si se contrae el citoesqueleto de actomiosina, ZO-1 se estira, y los módulos CFP y YFP se distancian entre sí, disminuyendo el FRET. Empleando esta construcción, el experimento reveló que en ausencia de ZO-2 aumenta la tensión en la unión estrecha.
Este mismo fenotipo de aumento de tensión en la unión estrecha, se observó previamente al silenciar a JAM-A, una proteína integral de las uniones estrechas. Esto entonces sugería que JAM-A y ZO-2 forman parte de un mismo complejo que regula la tensión en la unión estrecha. Para explorar este punto analizamos la expresión de JAM-A, encontrando que la falta de ZO-2 impide que JAM-A se ancle a las uniones estrechas (Fig. 1).
Ya se sabía que JAM-A se asocia a ZO-2, y se había publicado el análisis cristalográfico de los dominios que participan en esta interacción: PDZ-2 de ZO-2 y cola carboxilo terminal de JAM-A. Por ello, pudimos analizar in sílico la interacción entre estos dominios y descubrir los aminoácidos críticos de ZO-2 y JAM-A involucrados en esta asociación.
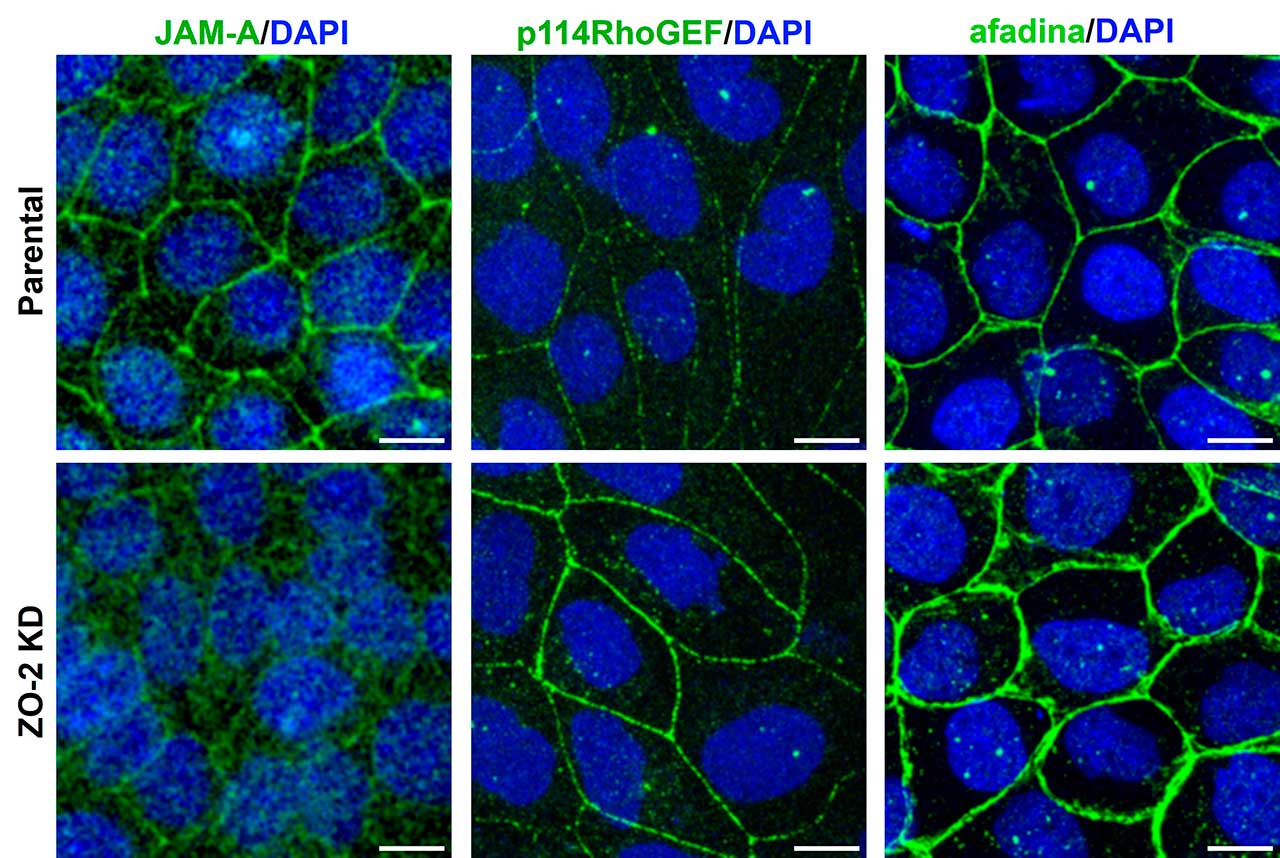
En seguida, nos preguntamos ¿por qué cuando falla la interacción entre JAM-A y ZO-2 aumenta la tensión en las uniones estrechas? Descubrimos que ello se debe a que si no hay ZO-2, no se recluta a JAM-A a la membrana, lo que provoca la acumulación de las proteínas p114RhoGEF y afadina en el borde celular (Fig. 2). Estas proteínas activan a la proteína RhoA y a la cinasa ROCK lo que aumenta la contracción del anillo de actomiosina que se conecta a las uniones estrechas.
Finalmente, nos preguntamos ¿Qué consecuencia tiene que aumente la tensión mecánica en las uniones estrechas? Sabíamos que en las monocapas sembradas sobre substratos suaves con una rigidez de 2.3-8.6 kPa, y no sobre substratos de mayor rigidez, el aumento de tensión en las uniones célula-célula hace que éstas se abran y, en consecuencia, aparezcan hoyos en el epitelio. Entonces, analizamos lo que sucede con la integridad de las monocapas de células parentales y ZO-2 KD, cuando las células se siembran sobre substratos que asemejan la rigidez normal del órgano, en este caso, el riñón. Para ello, en lugar de sembrar a las células sobre cajas de plástico o cubreobjetos de vidrio con una rigidez de 50-70 GPa, lo hicimos sobre hidrogeles con una rigidez de 20 kPa. Así, vimos que en las monocapas que carecen de ZO-2, y no en las parentales, se forman hoyos, lo cual sugiere que por el aumento de la tensión en las uniones estrechas, estas se abrieron, despegando entre sí a las células. Con este trabajo descubrimos que si falta ZO-2 y las células crecen sobre substratos suaves, la tensión mecánica de las uniones estrechas aumenta, y en consecuencia se rompe la integridad del epitelio, lo que evitaría que el organismo pudiera mantener aislado el contenido de los diferentes compartimentos del cuerpo.
En síntesis, encontramos que la proteína de la unión estrecha ZO-2 es esencial para mantener la tensión de la membrana apical ya que en su ausencia la tensión cae porque los microtúbulos y la γ-actina apical ya no se pueden conectar al cinturón de las uniones estrechas. La falta de ZO-2 en cambio, sube la tensión mecánica en las uniones estrechas, lo que ocurre porque la proteína integral de las uniones estrechas JAM-A ya no se puede anclar a las uniones a través de ZO-2 y en consecuencia p114RhoGEF y afadina se acumulan en el borde celular e inducen a través de RhoA/ROCK la contracción de la actomiosina. Este aumento en la tensión de la unión estrecha, vence la fuerza del contacto célula-célula y genera huecos que destruyen la integridad de las capas epiteliales.
Referencia
Pinto-Dueñas, D.C., Hernández-Guzmán, C., Marsch, P.M., Wadurkar, A.S., Martín-Tapia, D., Alarcón, L., Vázquez-Victorio, G., Méndez-Méndez, J.V., Chanona-Pérez, J.J., Nangia, S., González-Mariscal, L. (2024). The Role of ZO-2 in Modulating JAM-A and γ-Actin Junctional Recruitment, Apical Membrane and Tight Junction Tension, and Cell Response to Substrate Stiffness and Topography. International Journal of Molecular Sciences, 25 (5), 2453.